Τι είναι τα ισότοπα;
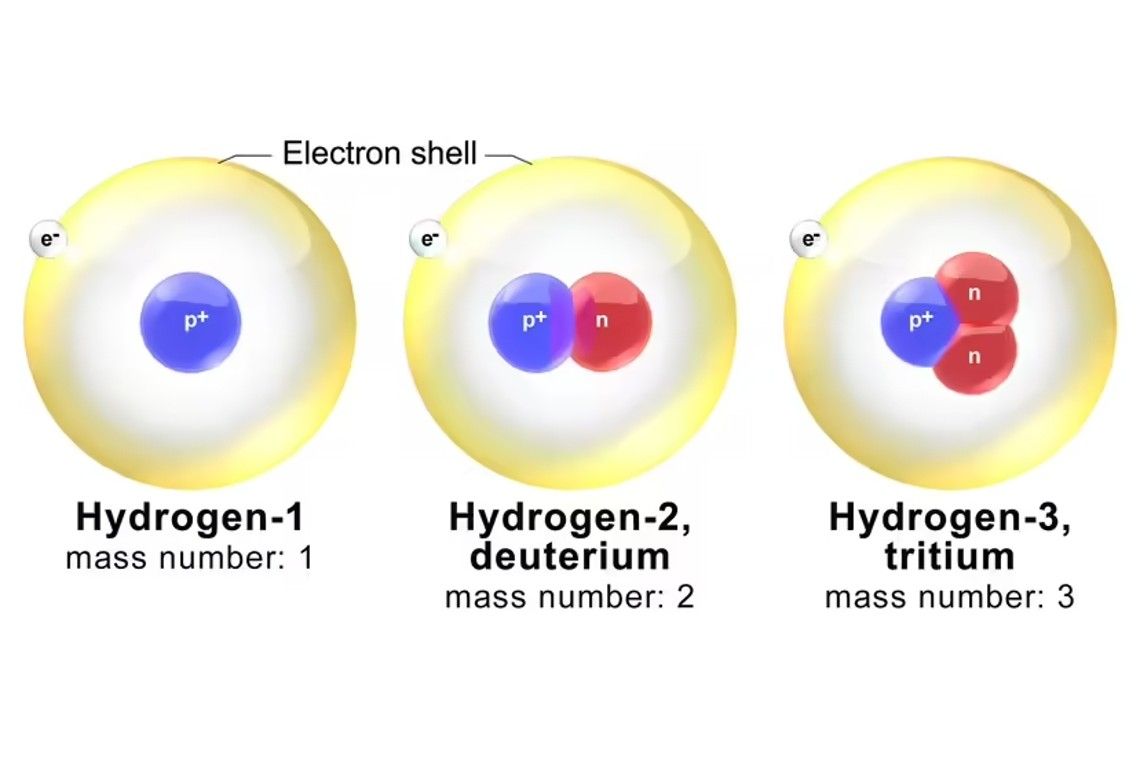
Κάθε ισότοπο ονομάζεται με βάση τον μαζικό του αριθμό, που είναι ο συνολικός συνδυασμένος αριθμός νετρονίων και πρωτονίων σε ένα άτομο.
Τα άτομα είναι τα «δομικά στοιχεία της ύλης». Οτιδήποτε έχει μάζα και καταλαμβάνει όγκο αποτελείται από αυτές τις μικροσκοπικές μονάδες. Αυτό ισχύει για τον αέρα που αναπνέετε, το νερό που πίνετε και το ίδιο το σώμα σας.
Τα ισότοπα είναι μια πολύ σημαντική έννοια στη μελέτη των ατόμων. Χημικοί, φυσικοί και γεωλόγοι τα χρησιμοποιούν για να κατανοήσουν τον κόσμο μας. Αλλά προτού μπορέσουμε να εξηγήσουμε τι είναι τα ισότοπα - ή γιατί είναι τόσο σημαντικά - θα χρειαστεί να κάνουμε ένα βήμα πίσω και να δούμε τα άτομα στο σύνολό τους.
Ο ατομικός μας κόσμος
Όπως ίσως γνωρίζετε, τα άτομα έχουν τρία κύρια δομικά στοιχεία, δύο από τα οποία βρίσκονται στον πυρήνα τους. Ο πυρήνας βρίσκεται στο κέντρο του ατόμου και είναι ένα σύμπλεγμα σωματιδίων τα οποία συνδέονται μεταξύ τους με μία από τις θεμελιώδεις δυνάμεις της φύσης, την ισχυρή πυρηνική δύναμη. Ένα είδος από αυτά τα σωματίδια είναι τα πρωτόνια, τα οποία έχουν θετικό ηλεκτρικό φορτίο.
Και ενώ είναι γνωστό ότι τα αντίθετα φορτία έλκονται και τα ομοίως φορτισμένα σώματα τείνουν να απωθούν το ένα το άλλο, προκύπτει ένα ερώτημα: πώς μπορούν δύο ή περισσότερα πρωτόνια - με θετικά φορτία- να συνυπάρχουν στον ίδιο πυρήνα; Δεν θα έπρεπε να απωθούν το ένα το άλλο;
Σε αυτό το σημείο έρχονται τα νετρόνια. Τα νετρόνια είναι υποατομικά σωματίδια που μοιράζονται τον πυρήνα με τα πρωτόνια. Αλλά τα νετρόνια δεν έχουν ηλεκτρικό φορτίο. Σύμφωνα με το όνομά τους, τα νετρόνια είναι ουδέτερα, δεν είναι ούτε θετικά ούτε αρνητικά φορτισμένα. Λόγω της ουδετερότητάς τους, τα νετρόνια μπορούν να εμποδίσουν τα πρωτόνια να απομακρύνουν το ένα το άλλο έξω από τον πυρήνα.
Ατομική δομή και ισότοπα
Σε τροχιά γύρω από τον πυρήνα βρίσκονται τα ηλεκτρόνια, εξαιρετικά ελαφριά σωματίδια με αρνητικά φορτία. Τα ηλεκτρόνια διευκολύνουν τη δημιουργία χημικών δεσμών και οι κινήσεις τους μπορούν να παράγουν αυτό που ονομάζουμε ηλεκτρική ενέργεια. Τα πρωτόνια δεν είναι, ωστόσο, λιγότερο σημαντικά. Μία βασική τους ιδιότητα είναι ότι βοηθούν τους επιστήμονες να ξεχωρίσουν τα στοιχεία μεταξύ τους.
Ίσως έχετε παρατηρήσει ότι στις περισσότερες εκδόσεις του περιοδικού πίνακα, κάθε τετράγωνο έχει έναν μικρό αριθμό τυπωμένο στην πάνω δεξιά γωνία του, πάνω από το σύμβολο του στοιχείου. Αυτός ο αριθμός είναι γνωστός ως ατομικός αριθμός. Λέει στον αναγνώστη πόσα πρωτόνια υπάρχουν στον πυρήνα ενός συγκεκριμένου στοιχείου. Για παράδειγμα, ο ατομικός αριθμός του οξυγόνου είναι οκτώ. Κάθε άτομο οξυγόνου στο σύμπαν έχει έναν πυρήνα με ακριβώς οκτώ πρωτόνια. ούτε περισσότερα, ούτε λιγότερα.
Χωρίς αυτή την πολύ συγκεκριμένη διάταξη σωματιδίων, το οξυγόνο δεν θα ήταν οξυγόνο. Ο ατομικός αριθμός κάθε στοιχείου - συμπεριλαμβανομένου του οξυγόνου - είναι εντελώς μοναδικός. Κανένα στοιχείο δεν μπορεί να έχει τον ίδιο ατομικό αριθμό με κάποιο άλλο. Κανένα άλλο στοιχείο δεν έχει οκτώ πρωτόνια στον πυρήνα του ατόμου του. Μετρώντας τον αριθμό των πρωτονίων, μπορούμε με σιγουριά να προσδιορίσουμε ένα στοιχείο. Ακριβώς όπως τα άτομα οξυγόνου θα έχουν πάντα οκτώ πρωτόνια, τα άτομα αζώτου έχουν πάντα επτά.
Τα νετρόνια δεν ακολουθούν αυτόν τον κανόνα. Όπως ειπώθηκε, ο πυρήνας σε ένα άτομο οξυγόνου είναι σίγουρο ότι φιλοξενεί οκτώ πρωτόνια. Ωστόσο, μπορεί επίσης να περιέχει μεταξύ τεσσάρων και 20 νετρονίων. Τα ισότοπα ενός στοιχείου είναι παραλλαγές του ίδιου στοιχείου που έχουν διαφορετικό αριθμό νετρονίων (και επομένως δυνητικά διαφορετικές φυσικές ιδιότητες). Ωστόσο, τείνουν να έχουν τις ίδιες χημικές ιδιότητες.
Τώρα, κάθε ισότοπο ονομάζεται με βάση τον μαζικό του αριθμό, που είναι ο συνολικός συνδυασμένος αριθμός νετρονίων και πρωτονίων σε ένα άτομο. Για παράδειγμα, ένα από τα πιο γνωστά ισότοπα οξυγόνου ονομάζεται οξυγόνο-18 (O-18). Έχει τα τυπικά οκτώ πρωτόνια συν 10 νετρόνια.
Επομένως, ο μαζικός αριθμός του O-18 είναι 18. Ένα άλλο ισότοπο, το οξυγόνο-17 (O-17), έχει ένα λιγότερο νετρόνιο στον πυρήνα του. Το O-16, έχει τον ίδιο αριθμό πρωτονίων και νετρονίων: οκτώ. Μεταξύ αυτής της τριάδας, το O-16 και το O-17 είναι τα ελαφρύτερα ισότοπα, και το O-16 είναι επίσης το πιο άφθονο ισότοπο από τα τρία.
Δειτε ακομη
Τα ισότοπα τείνουν να είναι ασταθή
Μερικά ισότοπα έχουν συνδυασμούς πρωτονίων και νετρονίων που τείνουν να είναι πιο σταθεροί. Στο προηγούμενο παράδειγμα των ισοτόπων του οξυγόνου, τα Ο-16, Ο-17 και Ο-18 είναι σταθερά ισότοπα. Σε ένα σταθερό ισότοπο, οι δυνάμεις που ασκούνται από τα πρωτόνια και τα νετρόνια τα συγκρατούν μεταξύ τους, διατηρώντας τον πυρήνα αμετάβλητο.
Από την άλλη πλευρά, ο πυρήνας σε ένα ραδιενεργό ισότοπο, που ονομάζεται επίσης "ραδιοϊσότοπο", είναι ασταθής και τείνει να αποσυντεθεί με την πάροδο του χρόνου. Ένα ραδιενεργό ισότοπο έχει μια αναλογία πρωτονίων προς νετρόνια που είναι θεμελιωδώς μη ευσταθής μακροπρόθεσμα. Αυτή η κατάσταση, ωθεί τα ραδιενεργά ισότοπα να αποβάλλουν ορισμένα υποατομικά σωματίδια (απελευθερώνοντας παράλληλα ενέργεια) μέχρι να μετατραπούν σε σταθερά ισότοπα.
Το O-18 είναι σταθερό, αλλά το οξυγόνο-19 (O-19) δεν είναι. Το τελευταίο αναπόφευκτα θα αποσυντεθεί. Για την ακρίβεια, αρκετά γρήγορα, σε 26,88 δευτερόλεπτα από τη δημιουργία του, ένα δείγμα Ο-19 είναι βέβαιο ότι θα χάσει τα μισά από τα άτομα του λόγω της ραδιενεργούς διάσπασης.
Αυτό σημαίνει ότι το O-19 έχει χρόνο ημιζωής 26,88 δευτερόλεπτα. Ο χρόνος ημιζωής είναι η ποσότητα του χρόνου που χρειάζεται το 50% ενός δείγματος ισοτόπου για να μεταβεί σε ένα άλλο ισότοπο. Αυτή ακριβώς η έννοια χρησιμοποιείται και στην παλαιοντολογία, όπως θα περιγραφεί ακολούθως.
Σε αντίθεση με το οξυγόνο, ορισμένα στοιχεία δεν έχουν καθόλου σταθερά ισότοπα. Σκεφτείτε το ουράνιο, ένα από τα πιο γνωστά ραδιενεργά στοιχεία. Στον φυσικό κόσμο υπάρχουν τρία ισότοπα αυτού του βαρέως μετάλλου, και είναι όλα ραδιενεργό, με τους ατομικούς πυρήνες σε μόνιμη κατάσταση διάσπασης. Τελικά, όταν όλοι οι πυρήνες σε ένα δείγμα ουρανίου διασπαστούν, αυτό θα μετατραπεί σε ένα εντελώς διαφορετικό στοιχείο στον περιοδικό πίνακα. Ωστόσο, πρέπει να σημειωθεί ότι η εν λόγω διαδικασία είναι στις περισσότερες των περιπτώσεων ιδιαίτερα αργή.
Χρονολόγηση και ιατρικές εφαρμογές
Το ουράνιο-238 (U-238), το πιο κοινό ισότοπο του ουρανίου και έχει χρόνο ημιζωής περίπου 4,5 δισεκατομμύρια χρόνια! Σταδιακά, θα μετατραπεί σε μόλυβδο-206 (Pb-206), το οποίο είναι ένα σταθερό ισότοπο. Ομοίως, το ουράνιο-235 (U-235), με χρόνο ημιζωής 704 εκατομμύρια έτη, μετατρέπεται σε μόλυβδο-207 (Pb-207), ένα άλλο σταθερό ισότοπο. Τόσο το U-238 όσο και το U-235 είναι παραδείγματα φυσικών ισοτόπων.
Για τους γεωλόγους, αυτή είναι πραγματικά χρήσιμη πληροφορία. Ας πούμε ότι κάποιος βρίσκει ένα κομμάτι βράχου με κρυστάλλους ζιργκόν, οι οποίοι περιέχουν ένα μείγμα U-235 και Pb-207. Η αναλογία αυτών των δύο ατόμων μπορεί να βοηθήσει τους επιστήμονες να προσδιορίσουν την ηλικία του βράχου.
Να πώς: Ας πούμε ότι ο αριθμός των ατόμων μολύβδου υπερτερεί κατά πολύ του αριθμού των ομολόγων τους σε ουράνιο. Σε αυτή την περίπτωση, ξέρετε ότι κοιτάτε έναν αρκετά παλιό βράχο. Εξάλλου, το ουράνιο είχε αρκετό χρόνο για να αρχίσει να μετατρέπεται σε μόλυβδο. Από την άλλη πλευρά, αν ισχύει το αντίθετο - και τα άτομα ουρανίου είναι περισσότερα - τότε ο βράχος έχει νεότερη γεωλογική ηλικία.
Η τεχνική που μόλις περιγράψαμε ονομάζεται ραδιομετρική χρονολόγηση. Αυτή είναι η πρακτική εφαρμογή των καλά τεκμηριωμένων ρυθμών διάσπασης ασταθών ισοτόπων για την εκτίμηση της ηλικίας των δειγμάτων πετρωμάτων και των γεωλογικών σχηματισμών. Οι παλαιοντολόγοι αξιοποιούν αυτή τη στρατηγική για να προσδιορίσουν πόσος χρόνος έχει περάσει από τότε που δημιουργήθηκε ένα συγκεκριμένο απολίθωμα, αν και δεν είναι πάντα δυνατό να χρονολογηθεί το δείγμα απευθείας.
Δεν χρειάζεται να είσαι αποκλειστικά λάτρης της προϊστορίας για να εκτιμήσεις τα ισότοπα. Η ιατρική επιστήμη χρησιμοποιεί τα ραδιενεργά ισότοπα για να παρακολουθεί τη ροή του αίματος, να μελετά την ανάπτυξη των οστών και ακόμη και να καταπολεμά κακοήθεις όγκους. Τα ραδιοϊσότοπα έχουν επίσης χρησιμοποιηθεί για να παρέχουν πληροφορίες ποιότητας του εδάφους σε αγροτικές καλλιέργειες.
Είναι σημαντικό ότι κάτι όχι απαραίτητα εντυπωσιακό με την πρώτη ματιά και αφηρημένο όσο η μεταβλητότητα των νετρονίων, επηρεάζει πολλούς επιστημονικούς τομείς, από τη θεραπεία νεοπλασιών μέχρι την επίλυση επιστημονικών ερωτημάτων που αναφέρονται στο παρελθόν του πλανήτη μας και της ζωής σε αυτόν.
Με πληροφορίες από HowStuffWorks.com